Através de varias pesquisas, achei umas tabelas periodicas online, umas boas e outras normais.
A primeira tabela que eu recomendo é essa do site: http://www.tabelaperiodicacompleta.com/ onde se você quiser ver apenas o numero atomico dos elementos você pode ver, tem uma opcão onde você pode escolher o que você quiser ver e não quiser ver.
A segunda tabela tem um pouco menos funcões que a primeira, você pode ver os orbitais, propriedades, entre outras funcões para acessar: http://www.ptable.com/?lang=pt
sexta-feira, 23 de novembro de 2012
Propriedades Periódicas e Aperiódicas? O que é isso?
Você deve está se perguntando o que é isso? Bem vamos por tópicos.
Propriedades periódicas: ocorrem à medida que o número atômico de um elemento químico aumenta, ou seja, assume valores que crescem e decrescem em cada período da Tabela Periódica.Há varios tipos de propriedades periódicas, são eles: raio atômico, energia de ionização, eletroafinidade, eletronegatividade, densidade, temperatura de fusão e ebulição e volume atômico.
Com o decorrer do tempo, iremos conferir cada tipo de propriedade periódica.
Propriedades aperiódicas : os valores desta propriedade variam à medida que o número atômico aumenta, mas não obedecem à posição na Tabela, ou seja, não se repetem em períodos regulares.
Exemplos de propriedades aperiódicas: calor específico, índice de refração, dureza e massa atômica.
sexta-feira, 9 de novembro de 2012
Distribuição Eletrônica
Os elétrons estão distribuídos em camadas ao redor do núcleo. Admite-se a existência de 7 camadas eletrônicas, designados pelas letras maiúsculas:
K,L,M,N,O,P e Q. À medida que as camadas se afastam do núcleo, aumenta a energia dos elétrons nelas localizados.
K,L,M,N,O,P e Q. À medida que as camadas se afastam do núcleo, aumenta a energia dos elétrons nelas localizados.

As camadas da eletrosfera representam os níveis de energia da eletrosfera. Assim, as camadas K,L,M,N,O, P e Q constituem os 1º, 2º, 3º, 4º, 5º, 6º e 7º níveis de energia, respectivamente.
Por meio de métodos experimentais, os químicos concluíram que o número máximo de elétrons que cabe em cada camada ou nível de energia é:
| Nível de energia | Camada | Número máximo de elétrons |
| 1º | K | 2 |
| 2º | L | 8 |
| 3º | M | 18 |
| 4º | N | 32 |
| 5º | O | 32 |
| 6º | P | 18 |
| 7º | Q | 2 (alguns autores admitem até 8) |
Em cada camada ou nível de energia, os elétrons se distribuem em subcamadas ou subníveis de energia, representados pelas letras s,p,d,f, em ordem crescente de energia.
O número máximo de elétrons que cabe em cada subcamada, ou subnivel de energia, também foi determinado experimentalmente:
O número máximo de elétrons que cabe em cada subcamada, ou subnivel de energia, também foi determinado experimentalmente:
energia crescente
---------------------------------->
---------------------------------->
| Subnível | s | p | d | f |
| Número máximo de elétrons | 2 | 6 | 10 | 14 |
O número de subníveis que constituem cada nível de energia depende do número máximo de elétrons que cabe em cada nível. Assim, como no 1ºnível cabem no máximo 2 elétrons, esse nível apresenta apenas um subnível s, no qual cabem os 2 elétrons. O subnível s do 1º nível de energia é representado por 1s.
Como no 2º nível cabem no máximo 8 elétrons, o 2º nível é constituído de um subnível s, no qual cabem no máximo 2 elétrons, e um subnível p, no qual cabem no máximo 6 elétrons. Desse modo, o 2º nível é formado de dois subníveis, representados por 2s e 2p, e assim por diante.
Como no 2º nível cabem no máximo 8 elétrons, o 2º nível é constituído de um subnível s, no qual cabem no máximo 2 elétrons, e um subnível p, no qual cabem no máximo 6 elétrons. Desse modo, o 2º nível é formado de dois subníveis, representados por 2s e 2p, e assim por diante.
Resumindo:
| Nível | Camada | Nº máximo de elétrons | Subníveis conhecidos |
| 1º | K | 2 | 1s |
| 2º | L | 8 | 2s e 2p |
| 3º | M | 18 | 3s, 3p e 3d |
| 4º | N | 32 | 4s, 4p, 4d e 4f |
| 5º | O | 32 | 5s, 5p, 5d e 5f |
| 6º | P | 18 | 6s, 6p e 6d |
| 7º | Q | 2 (alguns autores admitem até 8) | 7s 7p |
 Linus Carl Pauling (1901-1994), químico americano, elaborou um dispositivo prático que permite colocar todos os subníveis de energia conhecidos em ordem crescente de energia. É o processo das diagonais, denominado diagrama de Pauling, representado a seguir. A ordem crescente de energia dos subníveis é a ordem na sequência das diagonais.
Linus Carl Pauling (1901-1994), químico americano, elaborou um dispositivo prático que permite colocar todos os subníveis de energia conhecidos em ordem crescente de energia. É o processo das diagonais, denominado diagrama de Pauling, representado a seguir. A ordem crescente de energia dos subníveis é a ordem na sequência das diagonais.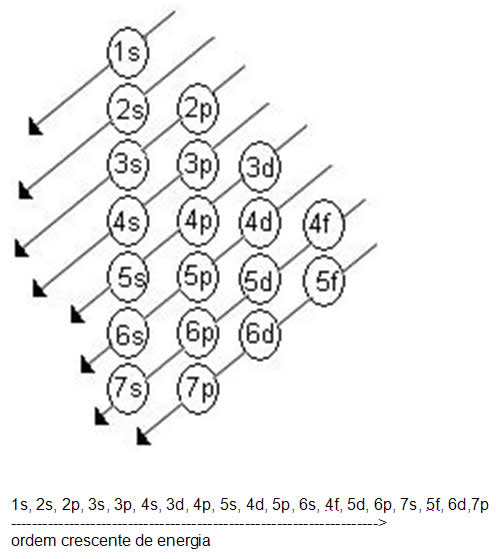
Acompanhe os exemplos de distribuição eletrônica:
1 - Distribuir os elétrons do átomo normal de manganês (Z=25) em ordem de camada.
Solução:
Se Z=25 isto significa que no átomo normal de manganês há 25 elétrons. Aplicando o diagrama de Pauling, teremos:
K - 1s2
L - 2s2 2p6
M - 3s2 3p6 3d5
N - 4s2 4p 4d 4f
O - 5s 5p 5d 5f
P - 6s 6p 6d
Q - 7s 7p
Resposta: K=2; L=8; M=13; N=2
2 - Distribuir os elétrons do átomo normal de xenônio (Z=54) em ordem de camada.
Solução:
K - 1s2
L - 2s2 2p6
M- 3s2 3p6 3d10
N- 4s2 4p6 4d10 4f
O- 5s2 5p6 5d 5f
P- 6s 6p 6d
Q- 7s 7p
Resposta: K=2; L=8; M=18; N=18; O=8
Há alguns elementos químicos cuja distribuição eletrônica não “bate” com o diagrama de Pauling.
Por Líria Alves
segunda-feira, 5 de novembro de 2012
sábado, 3 de novembro de 2012
Como decorar a tabela periódica? Eis a questão...

A tabela periódica é considerada bicho de sete cabeças por vários estudantes, mais na verdade não é bem assim. Para quem quer decorá-la sem se preocupar, aqui vão algumas dicas.
Você pode escrever uma música, associar a frases que farão com que você lembre, entre outas formas. Aqui vai uma forma bem simples.
8A – Helena Neruda Arrumou Karina Xereta como Rainha
He – hélio, Ne – neônio, Ar – argônio, Kr – criptônio, Xe – xenônio, Rn – radônio
Nome dos
compostos químicos da família 1A até 8A
1A –
LiNaK Robou Césio da França
Li- lítio, Na – sódio, K – potássio, Rb -rubídio, Cs – césio, Fr – frâncio
Li- lítio, Na – sódio, K – potássio, Rb -rubídio, Cs – césio, Fr – frâncio
2A –
Beatriz e Magnifica Cassou-se com Sr BaRao
Be – berílio, Mg – magnésio, Ca – cálcio, Sr – estrôncio, Ba – bário, Ra – rádio
Be – berílio, Mg – magnésio, Ca – cálcio, Sr – estrôncio, Ba – bário, Ra – rádio
3A- Belas
Alunas Galinhas Indo Telefonar
B – boro, Al – alumínio, Ga – gálio, In – índio, Tl – tálio
B – boro, Al – alumínio, Ga – gálio, In – índio, Tl – tálio
4A – Carlos
Silva Gerou Saneamento Público
C – Carbono, Si – Silício, Ge – germânio, Sn – estanho, Pb – chumbo
C – Carbono, Si – Silício, Ge – germânio, Sn – estanho, Pb – chumbo
5A –
Nossos Pais Assam Saborosos Bifes
N – nitrogênio, P – fósforo, As – ástato, Sb - antimônio, Bi – bismuto
N – nitrogênio, P – fósforo, As – ástato, Sb - antimônio, Bi – bismuto
6A – Os
Sete Porquinhos
O – oxigênio, S – enxofre, Se – selênio, Te – telúrio, Po – polônio
O – oxigênio, S – enxofre, Se – selênio, Te – telúrio, Po – polônio
7A –
Falam Claramente que Brahma é Igual Antarctica
F – flúor , Cl – cloro, Br – bromo, I – iodo, At – ástato
F – flúor , Cl – cloro, Br – bromo, I – iodo, At – ástato
He – hélio, Ne – neônio, Ar – argônio, Kr – criptônio, Xe – xenônio, Rn – radônio
By. Ester de Carvalho
Assinar:
Postagens (Atom)

