By: Ester de Carvalho.. =D
sexta-feira, 14 de dezembro de 2012
Piadas de química *-*
Se
você não manja nada de química não vai ver a mínima graça nessas piadas. Pare
por aqui. É sério!
Por que não se pode comer um elétron?
O que é uma molécula?
O que a bolacha de água e sal era antes?
Bolacha de ácido e base
Pra quem o hidrogênio ligou quando foi preso?
Pra ninguém, ele não tem família.
O que fazem 6 carbonos e 6 hidrogênios de mãos dadas na igreja?
Benzeno.
Como o oxigênio irá se suicidar?
Pulando de uma ponte de hidrogênio.
Dois ursos pulam na água mas só um se dissolve, por que?
Porque era um urso polar.
Qual o melhor papel higiênico do mundo?
Ácido acético, porque ácido fraco limpa o Cu.
Porque quando o hexano foi preso ele fugiu da cadeia?
Porque a cadeia era aberta.
Porque o índio não pega sol?
Porque ele está embaixo do Gálio.
Porque o indio serve como curativo?
Porque está em cima do tálio.
Porque o Frâncio vive bem informado?
Porque vive do lado do rádio.
O que é um ácido destilado?
Um ácido que não está mais daquele lado.
Porque ele tem spin!
O que o nêutron falou para o elétron quando atendeu seu telefonema?
Próton.
Onde o elétron joga futebol?
No campo eletromagnético.
Com o quê?
Com a eletrosfera.
O que são um monte de átomos de Cloro lado a lado?
É uma Clorofila.
É uma menina muito sapécula.
O que aconteceu ao cromo quando ele se assumiu?
Virou cromosshomossexual
Que nome se dá ao composto feito de cobre e índio, InCu?
Cupreto de índio.
Qual a fórmula da banana prata?
Ba(Na)²Ag.
E da banana d'água?
Ba(Na)²H2O
Qual é o cúmulo da química?
Dois Meteno e um Benzeno de Butinona.
Qual elemento não ri das piadas do Abutre e Costela?
O Cério.
Fonte: http://abutreecostela.blogspot.com.br/2010/03/piadas-de-quimica.html
By: Ester de Carvalho . . *-*
Ligações polares e apolares
Ligação iônica: neste tipo de ligação a transferência de elétrons é definitiva e por isso os compostos iônicos, como o próprio nome já diz, são carregados de cargas positivas e negativas e, portanto, apresentam pólos. A esta definição se aplica a regra:
Toda ligação iônica é uma ligação polar.
Ligação covalente: os pólos neste caso estão associados à eletronegatividade.
- Se a ligação covalente for entre átomos de mesma eletronegatividade, a ligação será apolar, porque não ocorre formação de pólos.
Exemplo: Br ─ Br
Como se trata da ligação entre elementos iguais (Bromo) e com mesma eletronegatividade, o composto se classifica como apolar.
- Agora, se a ligação covalente for entre átomos com eletronegatividades diferentes, a ligação será polar. Esta diferença induz o acúmulo de carga negativa ao redor do elemento mais eletronegativo, gerando assim, pólos na molécula.
A escala de eletronegatividade de Pauling facilita nosso estudo:Chamamos de polaridade a capacidade que as ligações possuem de atrair cargas elétricas, e o local onde ocorre este acúmulo denominamos de pólos, estes se classificam em pólos negativos ou positivos.
Vejamos agora a polaridade presente nas ligações iônicas e covalentes: Ligação iônica: neste tipo de ligação a transferência de elétrons é definitiva e por isso os compostos iônicos, como o próprio nome já diz, são carregados de cargas positivas e negativas e, portanto, apresentam pólos. A esta definição se aplica a regra:
Toda ligação iônica é uma ligação polar. Ligação covalente: os pólos neste caso estão associados à eletronegatividade.
- Se a ligação covalente for entre átomos de mesma eletronegatividade, a ligação será apolar, porque não ocorre formação de pólos.
Exemplo: Br ─ Br
Como se trata da ligação entre elementos iguais (Bromo) e com mesma eletronegatividade, o composto se classifica como apolar.
- Agora, se a ligação covalente for entre átomos com eletronegatividades diferentes, a ligação será polar. Esta diferença induz o acúmulo de carga negativa ao redor do elemento mais eletronegativo, gerando assim, pólos na molécula.
A eletronegatividade é crescente no sentido da seta. Vejam como é fácil memorizar
Toda ligação iônica é uma ligação polar.
Ligação covalente: os pólos neste caso estão associados à eletronegatividade.
- Se a ligação covalente for entre átomos de mesma eletronegatividade, a ligação será apolar, porque não ocorre formação de pólos.
Exemplo: Br ─ Br
Como se trata da ligação entre elementos iguais (Bromo) e com mesma eletronegatividade, o composto se classifica como apolar.
- Agora, se a ligação covalente for entre átomos com eletronegatividades diferentes, a ligação será polar. Esta diferença induz o acúmulo de carga negativa ao redor do elemento mais eletronegativo, gerando assim, pólos na molécula.
A escala de eletronegatividade de Pauling facilita nosso estudo:Chamamos de polaridade a capacidade que as ligações possuem de atrair cargas elétricas, e o local onde ocorre este acúmulo denominamos de pólos, estes se classificam em pólos negativos ou positivos.
Vejamos agora a polaridade presente nas ligações iônicas e covalentes: Ligação iônica: neste tipo de ligação a transferência de elétrons é definitiva e por isso os compostos iônicos, como o próprio nome já diz, são carregados de cargas positivas e negativas e, portanto, apresentam pólos. A esta definição se aplica a regra:
Toda ligação iônica é uma ligação polar. Ligação covalente: os pólos neste caso estão associados à eletronegatividade.
- Se a ligação covalente for entre átomos de mesma eletronegatividade, a ligação será apolar, porque não ocorre formação de pólos.
Exemplo: Br ─ Br
Como se trata da ligação entre elementos iguais (Bromo) e com mesma eletronegatividade, o composto se classifica como apolar.
- Agora, se a ligação covalente for entre átomos com eletronegatividades diferentes, a ligação será polar. Esta diferença induz o acúmulo de carga negativa ao redor do elemento mais eletronegativo, gerando assim, pólos na molécula.
A eletronegatividade é crescente no sentido da seta. Vejam como é fácil memorizar
“Fui Ontem No Clube, Briguei I Saí Correndo Para o Hospital”.
As letras em destaem negrito são elementos em escala decrescente de eletronegatividade.
Quanto maior a diferença de eletronegatividade, maior será a polaridade da ligação.
Um exemplo: a molécula de água é composta por hidrogênio (H) e oxigênio (O). Repare que de acordo com a escala, o “O” se encontra em uma extremidade e o “H” na outra, ou seja, estão bem distantes. Sendo assim, a molécula de H2O é considerada polar, pois os elementos que a formam possuem eletronegatividades distintas.
Se fôssemos fazer uma comparação: qual ligação, a covalente ou iônica, possui maior polaridade? A ligação iônica apresenta polarização máxima, ou seja, nenhum outro composto é mais polarizado que o composto iônico.
Por: Lucas Muniz
As letras em destaem negrito são elementos em escala decrescente de eletronegatividade.
Quanto maior a diferença de eletronegatividade, maior será a polaridade da ligação.
Um exemplo: a molécula de água é composta por hidrogênio (H) e oxigênio (O). Repare que de acordo com a escala, o “O” se encontra em uma extremidade e o “H” na outra, ou seja, estão bem distantes. Sendo assim, a molécula de H2O é considerada polar, pois os elementos que a formam possuem eletronegatividades distintas.
Se fôssemos fazer uma comparação: qual ligação, a covalente ou iônica, possui maior polaridade? A ligação iônica apresenta polarização máxima, ou seja, nenhum outro composto é mais polarizado que o composto iônico.
Por: Lucas Muniz
quinta-feira, 13 de dezembro de 2012
Ligação Ionica

A ligação iônica é chamada assim quando ocorre ligação entre o íons positivos e íons negativos.
Essa é a única ligação onde a transferencia de elétrons é definitiva, uma ligação iônica exerce força eletrostatica que atraem íons de cargas opostas.
Esse tipo de ligação geralmente acontece entre um átomo ou um agrupamento que tem tendencia de ceder elétrons com um átomo ou um agrupamento que tem tendencia de receber elétrons.
-->Estrutura iônica.
Compostos iônicos no estado sólido formam uma estrutura iônica contínua em um cristal iônico. A forma mais simples de cristal iônico é um cúbico simples. Nessa forma todos os átomos estão posicionados nas extremidades de um cubo. Essa célula unitária tem a massa que é a mesma de 1 dos átomos envolvidos. Quando todos os íons tem aproximadamente o mesmo tamanho, eles podem formar uma estrutura iguais chamada cúbica de face-centrada (onde a massa é 4
 massa atômica), mas, quando os íons tem tamanhos diferentes, a estrutura é geralmente cúbica de corpo-centrado (2 vezes a massa). Em retículos iônicos o número de coordenação se refere ao número de íons que cada retículo está ligado.
massa atômica), mas, quando os íons tem tamanhos diferentes, a estrutura é geralmente cúbica de corpo-centrado (2 vezes a massa). Em retículos iônicos o número de coordenação se refere ao número de íons que cada retículo está ligado.p.s: Eu tentei postar a minha cruzadinha assim como os outros colegas do blog, mas infelizmente não sei a onde eu a salvei.
Espero que meu post tenha ajudado....
by: Náthany B.
Cruzadinha sobre Ligações Quimicas!!!
Cruzadinha sobre Ligações Quimicas.
2. Um grande
número de elementos adquire estabilidade eletrônica quando seus átomos
apresentam oito elétrons na sua camada mais externa, que regra é essa?
3. Qual o outro
nome que podemos dar para as ligações Iônicas?
4. É um tipo de
ligação química baseada na atração eletrostática entre dois íons carregados com
cargas opostas, que ligação é essa?
5. Uma das características
dos compostos iônicos é o ponto de __________
7. As ligações
covalentes podem ser chamadas também de Ligações ___________
8. É aquela
onde os átomos possuem a tendência de compartilhar os elétrons de sua camada de
valência, que ligação é essa?
9. Uma das
características dos compostos moleculares é que quando puros, eles não conduzem
____________.
10. Os
compostos moleculares podem ser encontrados em quantos estados físicos?
11. Este tipo
de ligação ocorre quando os átomos envolvidos já atingiram a estabilidade com
os oito ou dois elétrons na camada de valência, essa ligação é as Ligações
Covalentes _____________.
12. As ligações
Metálicas ocorrem apenas entre ______________.
13. Segundo
essa teoria, alguns átomos do metal "perdem" ou "soltam"
elétrons de suas últimas camadas, isto é, teoria da nuvem _____________.
14. Uma das
propriedades dos metais é que eles têm resistência a _________
15. Os metais têm
um ponto de fusão elevado ou diminuído?
16. As ligações
químicas acontecem para que um átomo consiga atingir a regra do octeto ou seja
que consigam quantos elétrons na sua ultima camada eletrônica?
17. Quando um
átomo forte (com grande eletronegatividade) se liga a um átomo fraco (com baixa
eletronegatividade), há transferência definitiva de ______________.
18. A Ligação
Covalente acontece o compartilhamento do par de elétrons em órbita
_____________.
19. Átomo com
facilidade de adicionar elétrons à sua última camada.
20. A Teoria do
Octeto foi proposta por duas pessoas, uma delas é o...
Tipos de Ligações Covalentes.
TIPOS DE LIGAÇÕES COVALENTES:
Ligação covalente molecular
Nessa ligação, os átomos são unidos devido ao compartilhar de seus elétrons, surgem então os pares eletrônicos indicados pelo círculo: Ligação covalente molecular de dois átomos de Cloro (Cl).
Ligação covalente molecular de dois átomos de Cloro (Cl).
Cada par eletrônico formado pertence simultaneamente aos dois átomos. As moléculas são estruturas eletricamente neutras porque não ocorre nem ganho nem perda de elétrons, apenas o compartilhamento.
A água é um composto molecular constituído por dois átomos de hidrogênio (H2) e um de oxigênio (O).
Ligação covalente dativa e coordenada
Essa ligação obedece a Teoria do Octeto: Os átomos se unem tentando adquirir oito elétrons na camada de valência, ou seja, a configuração eletrônica dos gases nobres.
Sendo assim, um átomo que já atingiu a estabilidade eletrônica se une a outro que necessita de elétrons para completar a camada de valência. Um exemplo dessa ligação é quando um átomo de enxofre se liga a dois de oxigênio para formar o dióxido de enxofre (SO2).

O átomo de enxofre (S) adquire seu octeto com formação de uma dupla ligação com o oxigênio localizado à esquerda (ligação coordenada), mas ao mesmo tempo o oxigênio posicionado à direita necessita de elétrons para completar seu octeto. Surge então a ligação covalente dativa representada por um pequeno vetor (seta). A seta indica que o “S” está doando um par de elétrons para o “O”.
Vejamos o compartilhamento de elétrons na formação do composto trióxido de enxofre (SO3).
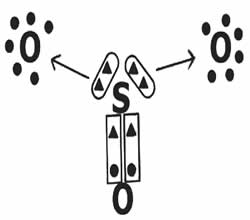
Note que o elemento central (enxofre) estabelece uma dupla ligação (coordenada) com um dos oxigênios, atingindo a estabilidade eletrônica (oito elétrons na camada de valência). Por outro lado, doa dois pares de elétrons para os oxigênios (ligação dativa indicada pela seta →) na tentativa de completar o octeto.
Nessa ligação, os átomos são unidos devido ao compartilhar de seus elétrons, surgem então os pares eletrônicos indicados pelo círculo:
 Ligação covalente molecular de dois átomos de Cloro (Cl).
Ligação covalente molecular de dois átomos de Cloro (Cl).
Cada par eletrônico formado pertence simultaneamente aos dois átomos. As moléculas são estruturas eletricamente neutras porque não ocorre nem ganho nem perda de elétrons, apenas o compartilhamento.
A água é um composto molecular constituído por dois átomos de hidrogênio (H2) e um de oxigênio (O).

Ligação covalente dativa e coordenada
Essa ligação obedece a Teoria do Octeto: Os átomos se unem tentando adquirir oito elétrons na camada de valência, ou seja, a configuração eletrônica dos gases nobres.
Sendo assim, um átomo que já atingiu a estabilidade eletrônica se une a outro que necessita de elétrons para completar a camada de valência. Um exemplo dessa ligação é quando um átomo de enxofre se liga a dois de oxigênio para formar o dióxido de enxofre (SO2).
O átomo de enxofre (S) adquire seu octeto com formação de uma dupla ligação com o oxigênio localizado à esquerda (ligação coordenada), mas ao mesmo tempo o oxigênio posicionado à direita necessita de elétrons para completar seu octeto. Surge então a ligação covalente dativa representada por um pequeno vetor (seta). A seta indica que o “S” está doando um par de elétrons para o “O”.
Vejamos o compartilhamento de elétrons na formação do composto trióxido de enxofre (SO3).

Note que o elemento central (enxofre) estabelece uma dupla ligação (coordenada) com um dos oxigênios, atingindo a estabilidade eletrônica (oito elétrons na camada de valência). Por outro lado, doa dois pares de elétrons para os oxigênios (ligação dativa indicada pela seta →) na tentativa de completar o octeto.
Ligações Covalentes.
Praticamente todos os ametais da tabela periódica
estabelecem entre si ligações onde há compartilhamento de elétrons, ou
seja, o par ou pares eletrônicos compartilhados fazem parte, quase que
simultaneamente, das eletrosferas dos participantes da ligação.
Alguns compostos como CO2, HCl, SiO2, AlCl3, são exemplos de espécies de maior caráter covalente
(frente ao caráter iônico – até porque esse não está totalmente
excluído): assim, tomando o dióxido de carbono, os dois átomos de
oxigênio (com 6 elétrons de valência) adquirem mais 2 elétrons do
carbono (com 4 de valência) e completam o octeto. Da mesma forma, como o
carbono compartilha 4 pares com cada átomo de oxigênio (portanto, 8
elétrons) também adquire condição de octeto completo.
Propriedades Periodicas e Aperiodicas.
Propriedades periódicas: ocorrem à medida que o número atômico de um elemento químico aumenta, ou seja, assume valores que crescem e decrescem em cada período da Tabela Periódica.
Entre as propriedades periódicas temos: raio atômico, energia de ionização, eletroafinidade, eletronegatividade, densidade, temperatura de fusão e ebulição e volume atômico.
Demonstração: a propriedade periódica eletronegatividade cresce de baixo para cima e da esquerda para a direita da Tabela, uma vez que quanto menor um átomo maior será sua eletronegatividade.
Propriedades aperiódicas: os valores desta propriedade variam à medida que o número atômico aumenta, mas não obedecem à posição na Tabela, ou seja, não se repetem em períodos regulares.
Exemplos de propriedades aperiódicas: calor específico, índice de refração, dureza e massa atômica. É válido ressaltar que a massa atômica sempre aumenta de acordo com o número atômico do elemento, e não diz respeito à posição deste elemento na Tabela.
quarta-feira, 12 de dezembro de 2012
Teste seus conhecimentos!
Cruzadinha sobre Ligação Química
DICAS
1. Um dos tipos de fórmula química
2. Compartilhamento desigual resulta em
ligações...
3. “Na natureza, nada se cria, nada se
perde, tudo se transforma”.
4. Ligação iônica normalmente acontece
entre...
5. 2H2 + O2 resulta:
6. Substancia composta de mesmos átomos
7. Aglomerado de átomos
8. Na ligação covalente os elétrons
são...
9. A ligação entre os átomos necessita
de...
10. Habilidade de um átomo de atrair
elétrons
11. Átomos tendem a combinar-se para se
estabilizar
12. H2O é
formado por uma ligação...
13. Ligações químicas formam...
14. NaCl é formado por ligação...
15. É um gás nobre
16. H2SO4 corresponde ao...
17. Metais tendem a formar...
18. Representação de um composto químico
19. Esse tipo de fórmula indica os
elétrons da camada de valência de cada átomo
20. Íon com carga negativa
 |
| CURTIU? |
Ester de Carvalho.. =D
Assinar:
Postagens (Atom)



